 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Protolysengleichgewichte: Wenn die Säure mit der Base ...
Puffer mit Lückentext
Kenntnisse
1. Berechnung von pH- Werten von allen Säuren und Basen.
2. Abschätzen, ob ein Stoff in Wasser sauer alkalisch oder neutral reagiert.
3. Den Taschenrechner bedienen.
4. Entscheiden, ob ein Stoff eine starke oder schwacheSäure oder Base ist.
5. Beschreiben, wie ein Puffer wirkt.
6. Begründen, warum eine Salzsäure mit pH=4 kein Puffer ist.
7. Puffer für bestimmte pH - Bereiche vorschlagen.
8. Die Zusammensetzung eines Puffer berechnen.
9. Titrationskurven beschreiben und interpretieren.
Aufgaben:
Folgende Titrationskurve wurde durch Titration mit 0,1 mol/l NaOH aufgenommen:
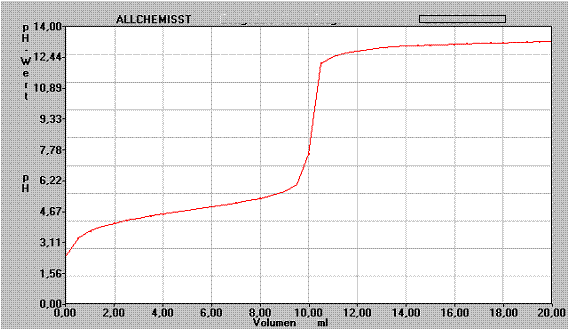
a) Beschreibe den Verlauf des Graphen.
b) Diskutiere die Frage, welche Stoffart hier titriert wurde und begründe den Verlauf des Graphen.
c) Kann man den Ks/Kb - Wert des titrierten Stoffes bestimmen? Begründe!
2. Hergestellt werden soll ein Puffer mit pH=7.
a) Erläutere und bergünde Zusammensetzung und Wirkungsweise eines Puffers.
b) Wähle ein Puffersystem aus und berechne seine Zusammensetzung für den gewünschten pH-Bereich.
c) Puffert die berechnete Lösung besser gegen Säure- oder Basenzugabe?
d) Setze die Konzentration der Säure des Puffers gleich 0,1 und berechne, welchen pH-Wert 20 ml der Lösung nach Zugabe von 5 ml 0,01 mol/l Salzsäure hat.
d) Welchen pH-Wert hätten 20 ml einer ungepufferten Lösung mit pH = 7 nach Zugabe der gleichen Säuremenge wie in d)?
3. Wie funktioniert ein Puffer?
Ein Puffer ist eine wäßrige Lösung, die .........................................................................gelöst enthält.
Entscheidend für die Vorgänge im Puffer ist, dass die .....................
die Protolysenreaktion der .................. (Reaktionsschema:........................................) und die Base
(Reaktionsschema:........................................) die Protolysenreaktion der .......................................
zurückdrängt. Somit liegt das ......................................... dieser beiden Reaktionen noch weiter
auf der ............................ Seite als es sowieso schon liegen würde, weil die reagierenden Teilchen
schwache .....................................................sind.
Unterscheide jetzt zwei Fälle:
a) Zugabe von Protonen (H3O+)
Eine Zugabe von Protonen zu einer ungepufferten Lösung, also zu einer Lösung in der keine ............
............................. vorhanden sind, hat zur Folge, dass die Zahl der Protonen genau um die Zahl
.................., die ................................... wurden. In einer gepufferten Lösung dagegen gibt es
......................., die mit den zugegebenen Protonen reagieren. Sie sind nämlich die stärksten in der
Lösung vorhandenen ................................ . In der Folge dieser Reaktion steigt die Zahl der
................................. . da die zugebenen Protonen ................................ . Logischerweise sinkt dann
die Zahl .............................. .
Also verändert sich der pH-Wert in einem Puffer überhaupt nicht? Der pH-Wert
verändert sich natürlich doch, denn wenn man davon ausgeht, das alle zugegebenen Protonen
mit der in der Lösung vorhandenen ................................. reagieren,
verändert sich doch dass Verhältnis der ..................... zu der ................................... .
Und da sich dadurch die Lage des oben angesprochenen ...............................verändert, liegt auch
der pH-Wert niedriger.
Merke Zahl der Teilchen pro Volumen nennt der Chemiker auch................................. .
b) Zugabe von Hydroxid- Ionen:
Formuliere selbst!
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung